SPEVIGO 150 mg, solution injectable en seringue préremplie, boîte de 2 seringues préremplies de 150 mg
Dernière révision : 25/09/2024
Taux de TVA : 2.1%
Laboratoire exploitant : BOEHRINGER INGELHEIM FRANCE
Spevigo est indiqué dans la prévention des poussées de psoriasis pustuleux généralisé (PPG) chez les adultes et les adolescents à partir de 12 ans.
Hypersensibilité sévère ou susceptible de menacer le pronostic vital à la substance active ou à l'un des excipients mentionnés à la rubrique Liste des excipients (voir rubrique Mises en garde spéciales et précautions d'emploi).
Infections actives cliniquement significatives (p. ex., tuberculose active ; voir rubrique Mises en garde spéciales et précautions d'emploi).
Traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Infections
Le spésolimab peut accroître le risque d'infections (voir rubrique Effets indésirables).
Chez les patients présentant une infection chronique ou des antécédents d'infection récidivante, il convient de tenir compte des risques potentiels et des bénéfices cliniques attendus du traitement avant de prescrire le spésolimab. En cas d'infection active cliniquement significative, le traitement par spésolimab ne doit pas être instauré avant que l'infection ait disparu ou soit traitée de façon adéquate. Les patients doivent être informés de la nécessité de consulter un médecin si des signes ou symptômes évocateurs d'une infection cliniquement significative surviennent pendant ou après le traitement par spésolimab.
Si le patient contracte une infection active cliniquement significative alors qu'il reçoit Spevigo en injection sous-cutanée pour la prévention des poussées de PPG, le traitement par Spevigo doit être arrêté. La réinstauration du traitement pourra être envisagée après la résolution de l'infection ou son traitement de façon adéquate.
Dépistage de la tuberculose avant le traitement
Le dépistage de la tuberculose doit être effectué avant l'instauration du traitement par spésolimab. Le spésolimab est contre-indiqué chez les patients présentant une tuberculose active (voir rubrique Contre-indications).
Un traitement antituberculeux doit être envisagé avant l'instauration du traitement par spésolimab chez les patients présentant une tuberculose latente ou des antécédents de tuberculose, ou ayant pu être exposés à des personnes présentant une tuberculose active, si l'administration d'un traitement complet et approprié ne peut être confirmée. Pendant et après le traitement par spésolimab, les patients doivent être placés sous surveillance à la recherche de signes et symptômes de tuberculose active.
Réactions d'hypersensibilité
Des réactions d'hypersensibilité peuvent survenir avec les anticorps monoclonaux tels que le spésolimab. L'hypersensibilité peut se manifester par des réactions immédiates telles qu'une anaphylaxie, ou par des réactions plus tardives telles qu'un syndrome d'hypersensibilité médicamenteuse avec éosinophilie et symptômes systémiques (syndrome DRESS).
Si le patient présente des signes d'anaphylaxie ou d'autre hypersensibilité grave, le traitement par spésolimab doit être immédiatement arrêté et un traitement approprié doit être instauré (voir rubrique Contre-indications).
Utilisation chez les patients présentant une poussée de PPG engageant le pronostic vital
Pour le traitement des poussées de PPG, se référer au résumé des caractéristiques du produit de Spevigo 450 mg solution à diluer pour perfusion.
Il n'existe aucune donnée sur l'utilisation du spésolimab chez les patients présentant une poussée de PPG engageant le pronostic vital ou une poussée nécessitant une prise en charge en soins intensifs.
Utilisation concomitante avec d'autres traitements du PPG ou avec des immunosuppresseurs
La sécurité et l'efficacité du spésolimab en association avec des immunosuppresseurs, y compris des traitements biologiques, n'ont pas été évaluées de manière systématique. Dans l'étude clinique de prévention des poussées de PPG, les autres traitements du PPG ont dû être arrêtés avant l'instauration du traitement par spésolimab, avec une période de sevrage thérapeutique (wash-out) pour la plupart des autres traitements (produits biologiques, autres traitements immunomodulateurs systémiques), ou arrêtés le jour de la randomisation (le jour de la mise en place du traitement préventif par spésolimab) (voir rubrique Propriétés pharmacodynamiques).
L'utilisation du spésolimab n'est pas recommandée
en association avec d'autres traitements du PPG. Pour prévenir le risque de
poussées du PPG, une diminution progressive des traitements précédents doit
être envisagée à l'instauration du traitement préventif du PPG par spésolimab.
Si nécessaire, d'autres traitements du PPG peuvent être utilisés
occasionnellement pendant le traitement (p. ex. en cas d'aggravation ou après
une poussée), à la discrétion du médecin traitant.
Vaccins
On ignore si le spésolimab affecte l'efficacité des vaccins.
Aucune donnée n'est disponible sur la transmission secondaire potentielle d'une infection par des vaccins vivants chez les patients recevant du spésolimab (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions). L'intervalle entre l'administration d'un vaccin vivant et l'instauration du traitement par spésolimab doit être d'au moins 4 semaines. Les vaccins vivants ne doivent pas être administrés pendant le traitement par spésolimab et pendant au moins 16 semaines après le traitement.
Avant d'instaurer un traitement par spésolimab pour la prévention des poussées de PPG, l'administration de tous les schémas vaccinaux appropriés, conformément aux recommandations vaccinales en vigueur, doit être envisagée.
Neuropathie périphérique
On ignore si le spésolimab est associé à un risque de neuropathie périphérique. Des cas de neuropathie périphérique ont été signalés lors des essais cliniques menés avec le spésolimab. Les médecins doivent être attentifs à l'apparition de symptômes pouvant évoquer la survenue d'une neuropathie périphérique.
Excipients
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c.-à-d. qu'il est essentiellement « sans sodium ».
Résumé du profil de sécurité
Les effets indésirables les plus fréquemment rapportés sont les infections (33,3 %), dont des infections graves chez 3 patients (3,2 %) (voir « Description de certains effets indésirables »).
Liste tabulée des effets indésirables
Le tableau 1 présente la liste des effets indésirables rapportés lors des essais cliniques. Les effets indésirables sont répertoriés par classe de systèmes d'organes MedDRA et par catégorie de fréquence selon la convention suivante : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000), très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Tableau 4 Effets indésirables
|
Classe de système d'organe |
Effet indésirable |
Fréquence |
|
Infections et infestations |
Infectiona) |
Très fréquent |
|
Affections de la peau et du tissu souscutané |
Prurit |
Fréquent |
|
Troubles généraux et anomalies au site d'administration |
Réactions au site d'injection |
Très fréquentb) |
|
Fatigue |
Fréquent |
a) Les infections les plus fréquemment
rapportées étaient les infections des voies urinaires (Fréquent) et les
infections des voies aériennes supérieures (Très fréquent).
b) Non signalé dans l'essai Effisayil 1
Description de certains effets indésirables
Infections
Durant la période contrôlée contre placebo d'une semaine de l'essai Effisayil 1, des infections ont été rapportées chez 17,1 % des patients traités par spésolimab, contre 5,6 % des patients ayant reçu le placebo. Dans l'essai Effisayil 1, une infection grave (infection des voies urinaires) a été rapportée chez 1 patient (2,9 %) du groupe spésolimab et chez aucun patient du groupe placebo. Durant la période contrôlée contre placebo de 48 semaines maximum de l'essai Effisayil 2, des infections ont été rapportées chez 33,3 % des patients traités par Spevigo et chez 33,3 % des patients ayant reçu le placebo. Dans l'essai Effisayil 2, des infections graves ont été rapportées chez 3 patients (3,2 %) du groupe Spevigo et chez aucun patient du groupe placebo.
Les infections observées au cours des essais cliniques sur le spésolimab étaient généralement d'intensité légère à modérée, sans profil spécifique concernant l'agent pathogène ou la nature de l'infection.
Réactions au site d'injection
Les réactions au site d'injection comprennent : érythème, gonflement, douleur, induration, chaleur, desquamation, papule, prurit, éruption cutanée et urticaire au site d'injection. Les réactions au site d'injection étaient généralement d'intensités légères à modérées.
Population pédiatrique
Les données disponibles chez les adolescents sont limitées. Huit patients adolescents atteints de PPG âgés de 14 à 17 ans ont été inclus dans l'essai Effisayil 2 (voir rubrique Propriétés pharmacodynamiques). Dans l'ensemble, le profil de sécurité chez les adolescents traités avec le spésolimab (n = 6) correspondait au profil de sécurité chez les adultes et aucun nouveau problème de sécurité n'a été identifié.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration - voir Annexe V.
AVANT
INSTAURATION du traitement :
- EFFECTUER un dépistage de la tuberculose.
- ENVISAGER l'administration de tous les schémas vaccinaux appropriés, conformément aux recommandations vaccinales en vigueur.
SURVEILLANCE du traitement :
- Rechercher des signes et symptômes de tuberculose active.
ALLAITEMENT :
- L'excrétion d'anticorps IgG dans le lait s'observe durant les premiers jours après l'accouchement et diminue rapidement par la suite jusqu'à atteindre de faibles concentrations. En conséquence, des anticorps IgG peuvent être transmis au nouveau-né durant les premiers jours de l'allaitement. Durant cette courte période, un risque pour l'enfant allaité ne peut être exclu. Passé cette période, le spésolimab peut être utilisé pendant l'allaitement si cela est cliniquement nécessaire. Si le traitement a été arrêté avant le dernier trimestre de grossesse, l'allaitement peut être commencé immédiatement après l'accouchement.
- EFFECTUER un dépistage de la tuberculose.
- ENVISAGER l'administration de tous les schémas vaccinaux appropriés, conformément aux recommandations vaccinales en vigueur.
SURVEILLANCE du traitement :
- Rechercher des signes et symptômes de tuberculose active.
ALLAITEMENT :
- L'excrétion d'anticorps IgG dans le lait s'observe durant les premiers jours après l'accouchement et diminue rapidement par la suite jusqu'à atteindre de faibles concentrations. En conséquence, des anticorps IgG peuvent être transmis au nouveau-né durant les premiers jours de l'allaitement. Durant cette courte période, un risque pour l'enfant allaité ne peut être exclu. Passé cette période, le spésolimab peut être utilisé pendant l'allaitement si cela est cliniquement nécessaire. Si le traitement a été arrêté avant le dernier trimestre de grossesse, l'allaitement peut être commencé immédiatement après l'accouchement.
Grossesse
Il n'existe pas de données ou il existe des données limitées sur l'utilisation du spésolimab chez la femme enceinte. Les études non cliniques menées avec un substitut d'anticorps monoclonal antiIL36R murin n'ont pas mis en évidence d'effets délétères directs ou indirects sur la reproduction (voir rubrique Données de sécurité préclinique). L'immunoglobuline humaine (IgG) est connue pour traverser la barrière placentaire. Par mesure de précaution, il est préférable d'éviter l'utilisation du spésolimab pendant la grossesse.
Allaitement
Il n'existe pas de données sur l'excrétion du spésolimab dans le lait maternel. Chez l'être humain, l'excrétion d'anticorps IgG dans le lait s'observe durant les premiers jours après l'accouchement et diminue rapidement par la suite jusqu'à atteindre de faibles concentrations. En conséquence, des anticorps IgG peuvent être transmis au nouveau-né durant les premiers jours de l'allaitement. Durant cette courte période, un risque pour l'enfant allaité ne peut être exclu. Passé cette période, le spésolimab peut être utilisé pendant l'allaitement si cela est cliniquement nécessaire. Si le traitement a été arrêté avant le dernier trimestre de grossesse, l'allaitement peut être commencé immédiatement après l'accouchement.
Fertilité
Aucune donnée n'est disponible concernant les effets du spésolimab sur la fertilité humaine. Les études menées sur la souris avec un substitut d'anticorps monoclonal anti-IL36R murin n'ont pas mis en évidence d'effets délétères directs ou indirects sur la fertilité par antagonisme de l'IL36R (voir rubrique Données de sécurité préclinique).
Aucune étude d'interaction n'a été réalisée. Chez les patients atteints de PPG, il n'est pas attendu que le spésolimab ait un impact sur les médicaments concomitants métabolisés par les enzymes du CYP.
Aucun vaccin vivant ne doit être co-administré avec le spésolimab (voir rubrique Mises en garde spéciales et précautions d'emploi).
L'expérience de l'utilisation concomitante du spésolimab avec des immunosuppresseurs est limitée (voir rubrique Mises en garde spéciales et précautions d'emploi).
Le traitement doit être instauré et supervisé par un médecin expérimenté dans la prise en charge des maladies inflammatoires cutanées.
Le traitement peut être initié en injection sous-cutanée avec la seringue préremplie pour la prévention des poussées de PPG, ou avec une dose de spésolimab par voie intraveineuse en traitement d'une poussée de PPG (se référer au résumé des caractéristiques du produit de Spevigo 450 mg solution à diluer pour perfusion).
Posologie
La dose recommandée pour la prévention d'une poussée de PPG chez les adultes et les adolescents âgés de plus de 12 ans et pesant au moins 40 kg est d'une dose de charge de 600 mg (4 injections de 150 mg) par voie sous-cutanée, suivie de 300 mg (2 injections de 150 mg) par voie sous-cutanée toutes les 4 semaines.
Spevigo n'a pas été étudié chez les patients pesant moins de 40 kg. D'après les modélisations et les simulations pharmacocinétiques, la dose recommandée chez les adolescents âgés de 12 ans ou plus et pesant ≥ 30 et < 40 kg est une dose de charge de 300 mg (deux injections de 150 mg) administrée par voie sous-cutanée, suivie d'une dose de 150 mg (une injection de 150 mg) administrée par voie sous-cutanée toutes les 4 semaines (voir rubrique Propriétés pharmacocinétiques).
Les données cliniques concernant l'utilisation concomitante d'autres traitements du PPG avec le spésolimab sont limitées. L'utilisation du spésolimab n'est pas recommandée en association avec d'autres traitements du PPG et une diminution progressive des traitements précédents du PPG doit être envisagée à l'instauration du traitement par spésolimab (voir rubriques Mises en garde spéciales et précautions d'emploi et Interactions avec d'autres médicaments et autres formes d'interactions).
Traitement d'une poussée de PPG survenant pendant le traitement préventif par voie sous-cutanée En cas de poussée de PPG survenant pendant le traitement par Spevigo en injection sous-cutanée, celle-ci peut être traitée par Spevigo en administration intraveineuse (voir le résumé des caractéristiques du produit de Spevigo 450 mg solution à diluer pour perfusion).
Instauration ou réinstauration du traitement préventif par voie sous-cutanée après le traitement d'une poussée de PPG par voie intraveineuse
Quatre semaines après l'administration intraveineuse de Spevigo, le traitement par Spevigo en injection sous-cutanée peut être initié ou réinstauré. L'administration d'une dose de charge par voie sous-cutanée n'est pas nécessaire.
Oubli d'une dose
En cas d'oubli d'une dose, celle-ci doit être administrée dès que possible. Le traitement peut ensuite reprendre selon le calendrier d'administration habituel.
Populations particulières
Patients âgés
Aucun ajustement posologique n'est requis.
Insuffisance rénale ou hépatique
Le spésolimab n'a pas été étudié de spécifiquement dans ces populations de patients. Ces troubles n'ont généralement pas d'incidence cliniquement significative sur la pharmacocinétique des anticorps monoclonaux, et aucun ajustement posologique n'est jugé nécessaire.
Population pédiatrique
La sécurité et l'efficacité du spésolimab chez les enfants âgés de moins de 12 ans n'ont pas été établies.
Mode d'administration
L'injection doit être administrée par voie sous-cutanée dans le haut de la cuisse ou dans l'abdomen. La seringue préremplie ne doit pas être injectée dans des zones où la peau est sensible, érythémateuse ou indurée, ni dans les ecchymoses et les cicatrices.
Adultes et adolescents âgés de 12 ans ou plus et pesant au moins 40 kg
La dose de charge de 600 mg en injection sous-cutanée (voir la rubrique « Posologie ») doit être administrée par un professionnel de santé. Le site d'injection doit être différent à chaque injection et doit se situer à une distance d'au moins 2 cm des autres sites d'injection.
Par la suite, si le professionnel de santé le juge approprié, les injections sous-cutanées de 300 mg peuvent être réalisées par le patient lui-même ou par un aidant à l'aide de la seringue préremplie après avoir été formé à la bonne technique d'injection.
Pour administrer une dose complète de 300 mg, 2 seringues préremplies de 150 mg doivent être utilisées, l'une après l'autre. Les sites d'injection doivent être différents pour chacune des deux injections, et doivent être distants d'au moins 2 cm l'un de l'autre.
La notice contient des instructions d'utilisation détaillées.
Adolescents âgés de 12 ans ou plus et pesant ≥ 30 et < 40 kg Spevigo doit être administré par un professionnel de santé.
Pour la dose de charge de 300 mg en injection sous-cutanée (voir la rubrique « Posologie »), utiliser deux seringues préremplies de 150 mg l'une après l'autre. Le site d'injection doit être différent à chaque injection et doit se situer à une distance d'au moins 2 cm des autres sites d'injection. Pour les doses suivantes de 150 mg, utiliser une seringue préremplie de 150 mg.
Durée de conservation :
2 ans
Précautions particulières de conservation :
À conserver au réfrigérateur (entre 2 °C et 8 °C).
Ne pas congeler. Ne pas utiliser la seringue préremplie de Spevigo si elle a été congelée, et ce même si elle a été décongelée.
À conserver dans l'emballage d'origine à l'abri de la lumière.
Avant utilisation, la seringue préremplie peut être conservée à des températures ne dépassant pas 25 °C pendant 14 jours maximum dès lors qu'elle est conservée dans son emballage d'origine à l'abri de la lumière. La seringue préremplie de Spevigo doit être éliminée si elle a été conservée à température ambiante (25 °C maximum) pendant plus de 14 jours.
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments.
La dose maximale de spésolimab administrée dans le cadre des essais cliniques était de 1 200 mg par voie intraveineuse ou sous-cutanée. Les effets indésirables observés après l'administration d'une dose unique ou de doses répétées pouvant aller jusqu'à 1 200 mg concordaient avec le profil de sécurité connu du spésolimab.
En cas de surdosage, il est recommandé de surveiller l'apparition de signes ou symptômes d'effets indésirables et d'instaurer un traitement symptomatique si nécessaire.
Classe pharmacothérapeutique : immunosuppresseurs, inhibiteurs d'interleukines, Code ATC : L04AC22
Mécanisme d'action
Le spésolimab est un anticorps monoclonal antagoniste humanisé de type immunoglobuline G1 (IgG1) qui bloque la voie de signalisation du récepteur humain de l'interleukine 36 (IL36R). La liaison du spésolimab à l'IL36R empêche l'activation de l'IL36R par ses ligands (IL36 α, β et γ) ainsi que l'activation en aval des voies de signalisation pro-inflammatoires.
Effets pharmacodynamiques
Après l'administration intraveineuse de spésolimab à des
patients atteints de PPG, une baisse des taux de protéine C réactive (CRP),
d'IL6, de cytokines produites par les lymphocytes T auxiliaires (Th1/Th17), de
marqueurs d'inflammation produits par les kératinocytes, de médiateurs
neutrophiles et de cytokines pro-inflammatoires a été observée dans le sérum et
au niveau de la peau à la semaine 1 par rapport à l'inclusion, et a été
associée à une baisse de la sévérité clinique. Lors de la dernière mesure à la
semaine 8 de l'essai Effisayil 1, la réduction de ces biomarqueurs s'était
accentuée.
Efficacité et sécurité cliniques
Effisayil 2 (1368-0027)
Une étude de phase IIb randomisée, en double aveugle, contrôlée contre placebo (Effisayil 2) a évalué l'efficacité et la sécurité du spésolimab en administration sous-cutanée chez des adultes et des adolescents présentant des antécédents de PPG, selon les critères ERASPEN, quel que soit leur statut mutationnel IL36RN, et ayant déjà présenté au moins deux poussées de PPG d'intensité modérée à sévère. Les patients étaient randomisés s'ils présentaient un score total de 0 ou 1 à l'échelle GPPGA au moment de la sélection et de la randomisation. Les patients devaient arrêter tout traitement systémique et topique du PPG avant ou au moment de la randomisation. Ces patients devaient avoir présentés des antécédents de poussées de PPG sous traitement ou lors d'une diminution de dose ou lors de l'interruption de ce traitement concomitant.
Le critère principal de l'étude était le délai de survenue de la première poussée de PPG jusqu'à la semaine 48 (définie comme un sous-score de pustulation ≥ 2 à l'échelle GPPGA et une augmentation ≥ 2 du score total GPPGA par rapport à l'inclusion). Le principal critère secondaire était la survenue d'au moins une poussée de PPG jusqu'à la semaine 48. Les autres critères secondaires à la semaine 48 étaient le délai de survenue de la première aggravation à l'échelle PSS (Psoriasis Symptom Scale, échelle d'évaluation des symptômes de psoriasis) et au questionnaire DLQI (Dermatology Quality of Life Index, questionnaire d'évaluation de la qualité de vie en dermatologie), définie comme une augmentation de 4 points du score total par rapport à l'inclusion.
Au total, 123 patients ont été randomisés (rapport de 1:1:1:1) pour recevoir l'un des 4 traitements de l'étude (voir tableau 2).
Tableau 2 : Groupes de traitement de l'essai Effisayil 2
|
|
Dose de charge |
Doses suivantes |
|
spésolimab |
600 mg par voie sous-cutanée |
300 mg par voie sous-cutanée toutes les 4 semaines |
|
spésolimab |
600 mg par voie sous-cutanée |
300 mg par voie sous-cutanée toutes les 12 semaines |
|
spésolimab |
300 mg par voie sous-cutanée |
150 mg par voie sous-cutanée toutes les 12 semaines |
|
Placebo |
Administration par voie souscutanée |
Administration par voie sous-cutanée toutes les 4 semaines |
Les patients de l'étude étaient à 38,2 % de sexe masculin et à 61,8 % de sexe féminin. L'âge moyen était de 40,4 ans (intervalle : 14 à 75 ans). La population de l'étude comptait 8 patients adolescents (6,5 % ; 2 dans chaque groupe de traitement) et était composée de 64,2 % de patients asiatiques et de 35,8 % de patients caucasiens. Les patients inclus dans l'étude présentaient un sous-score de pustulation de 1 (28,5 %) ou de 0 (71,5 %) à l'échelle GPPGA et un score total de 1 (86,2 %) ou 0 (13,8 %) à l'échelle GPPGA. Au moment de la randomisation, 74,8 % des patients recevaient un traitement systémique du PPG, qui a été arrêté à l'instauration du traitement de l'étude.
Bien que 3 schémas posologiques ont été étudiés dans l'essai Effisayil 2, le schéma posologique de spésolimab recommandé pour la prévention des poussées de PPG est d'une dose de charge de 600 mg par voie sous-cutanée suivie de 300 mg par voie sous-cutanée toutes les 4 semaines (voir rubrique Posologie et mode d'administration). Les résultats présentés ci-dessous se rapportent au schéma posologique recommandé.
En cas de poussée, les patients pouvaient recevoir jusqu'à 2 doses de 900 mg de spésolimab par voie intraveineuse en ouvert (voir rubrique Posologie et mode d'administration). Deux patients du groupe spésolimab à la dose recommandée (6,7 %) et 15 patients du groupe placebo (48,4 %) ont reçu le traitement aigu par voie intraveineuse.
En comparaison au placebo, le traitement par spésolimab à la dose recommandée a montré une amélioration statistiquement significative du critère d'évaluation principal et du principal critère d'évaluation secondaire (voir tableau 3).
Tableau 3 : Délai de survenue de la première poussée de PPG et survenue d'au moins une poussée de PPG jusqu'à la semaine 48 (Effisayil 2)
|
|
Placebo |
|
Spésolimab à la dose recommandée |
|
Nombre de patients analysés, N |
31 |
|
30 |
|
Patients ayant présenté des poussées de PPG, N (%)* |
16 (51,6) |
|
3 (10,0) |
|
Hazard ratio (HR)** pour le délai de survenue de la première poussée, par rapport au placebo (IC à 95 %) |
|
0,16 (0,05 ; 0,54) |
|
|
Valeur p*** |
|
0,0005 |
|
|
Différence de risque de survenue d'une poussée de PPG, par rapport au placebo (IC à 95 %) |
|
-39,0 % (-62,1 ; -15,9) |
|
|
Valeur p**** |
|
0,0013 |
|
* L'administration de spésolimab par voie intraveineuse ou d'un traitement standard prescrit par l'investigateur, destiné à traiter une aggravation du PPG, était envisagée lors de la survenue d'une poussée de PPG. ** Modèle de régression de Cox stratifié sur la prise de médicaments systémiques contre le PPG à la randomisation.
*** Test du log rank stratifié sur la prise de médicaments systémiques contre le PPG à la randomisation, valeur p unilatérale.
**** Test de Cochran-Mantel-Haenszel après imputation multiple, stratifié sur la prise de médicaments systémiques contre le PPG à la randomisation, valeur p unilatérale.
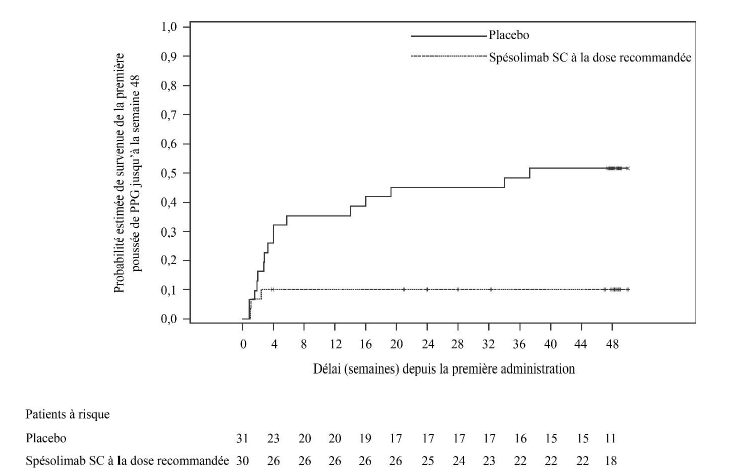
L'efficacité de la dose recommandée de spésolimab par voie sous-cutanée par rapport au placebo a été observée peu de temps après la randomisation et s'est maintenue jusqu'à la semaine 48 (figure 1).
Figure 1 : Délai de survenue de la
première poussée de PPG jusqu'à la semaine 48 (Effisayil 2)
Un effet du traitement a été observé chez tous les patients, quel que soit leur statut mutationnel IL36RN pour le critère d'évaluation principal et pour le principal critère d'évaluation secondaire.
Un patient adolescent du groupe placebo a reçu un traitement standard prescrit par l'investigateur, destiné à traiter une aggravation du PPG, ce qui a été considéré comme une poussée de PPG. Aucun patient adolescent du groupe spésolimab à la dose recommandée n'a présenté de poussée de PPG.
Au regard des scores aux échelles PSS et DLQI, un effet préventif sur l'aggravation du PPG a également été observé, comme le confirme le hazard ratio de 0,42 (IC à 95 % : 0,20-0,91) pour le score PSS et de 0,26 (IC à 95 % : 0,11-0,62) pour le score DLQI.
Immunogénicité
Chez les patients atteints de PPG traités par spésolimab par voie intraveineuse dans l'essai Effisayil 1, 46 % ont développé des anticorps anti-médicament (AAM). La majorité des patients positifs aux AAM ont également développé des anticorps neutralisants. Dans l'essai Effisayil 2, après plusieurs doses sous-cutanées de spésolimab, 41 % des patients ont développé des AAM. La majorité des patients positifs aux AAM ont également développé des anticorps neutralisants.
La clairance du spésolimab a augmenté avec les titres d'AAM.
Les données relatives à l'administration d'une nouvelle dose chez des patients ayant développé des AAM (n = 4) sont limitées étant donné que la majorité des patients de l'essai Effisayil 1 n'ont pas présenté de nouvelle poussée. À ce jour, on ignore s'il existe une corrélation entre la présence d'AAM anti-spésolimab et le maintien de l'efficacité en cas de traitement d'une poussée. Après administration de spésolimab par voie sous-cutanée dans l'essai Effisayil 2, la présence d'AAM n'a pas eu d'incidence manifeste sur l'efficacité ou la sécurité.
Population pédiatrique
L'Agence européenne des médicaments a accordé une dérogation à l'obligation de soumettre les résultats d'études réalisées avec Spevigo dans la population pédiatrique de moins de 12 ans dans le traitement du psoriasis pustuleux généralisé (voir rubrique Posologie et mode d'administration pour les informations concernant l'usage pédiatrique).
Un modèle pharmacocinétique de population a été élaboré sur la base des données recueillies chez des volontaires sains, chez des patients atteints de PPG et chez des patients présentant d'autres maladies. Après une dose unique de 900 mg en intraveineuse, l'ASC0‑∞ (IC à 95 %) et la Cmax (IC à 95 %) estimées par le modèle pharmacocinétique de population chez un patient type atteint de PPG n'ayant pas développé d'AAM étaient respectivement de 4 750 (4 510 ; 4 970) µg·j/mL et de 238 (218 ; 256) µg/mL. Après l'administration d'une dose de charge de 600 mg de spésolimab par voie souscutanée puis d'une dose de 300 mg de spésolimab par voie sous-cutanée toutes les 4 semaines, la concentration résiduelle moyenne (%CV) à l'état d'équilibre était comprise entre 33,4 µg/mL (37,6 %) et 42,3 µg/mL (43,0 %).
Absorption
Après administration sous-cutanée d'une dose unique de spésolimab chez des volontaires sains, les concentrations plasmatiques maximales ont été atteintes au bout de 5,5 à 7,0 jours. Après administration sous-cutanée dans l'abdomen, la biodisponibilité absolue était légèrement plus élevée aux doses supérieures, avec des valeurs estimatives de 58 %, 65 % et 72 % aux doses de 150 mg, 300 mg et 600 mg respectivement. Sur la base de données limitées, la biodisponibilité absolue était d'environ 85 % après administration sous-cutanée de 300 mg de spésolimab dans la cuisse.
Distribution
D'après l'analyse pharmacocinétique de population, le volume de distribution habituel à l'état d'équilibre était de 6,4 L.
Biotransformation
La voie métabolique du spésolimab n'a pas été caractérisée. S'agissant d'un anticorps monoclonal IgG1 humanisé, il est attendu que le spésolimab se dégrade en petits peptides et acides aminés par catabolisme, d'une manière comparable aux IgG endogènes.
Élimination
Dans l'intervalle de dose linéaire (0,3 à 20 mg/kg), d'après le modèle pharmacocinétique de population, la clairance du spésolimab (IC à 95 %) chez un patient type atteint de PPG n'ayant pas développé d'AAM et pesant 70 kg était de 0,184 L/j. La demi-vie terminale était de 25,5 jours.
Linéarité/non-linéarité
Après administration d'une dose unique par voie intraveineuse, le spésolimab a présenté une pharmacocinétique linéaire avec une augmentation de l'exposition proportionnelle à la dose à des doses comprises entre 0,3 et 20 mg/kg. La clairance (Cl) et la demi-vie terminale étaient toutes deux indépendantes de la dose. Après administration d'une dose unique par voie sous-cutanée, l'exposition au spésolimab a augmenté légèrement plus que proportionnellement à la dose à des doses comprises entre 150 mg et 600 mg, car sa biodisponibilité est légèrement supérieure à des doses plus élevées.
Poids corporel
Les concentrations de spésolimab étaient plus faibles chez les patients de poids corporel plus élevé, et plus élevées chez les patients de poids corporel plus faible. Le spésolimab n'a pas été étudié chez les patients atteints de PPG pesant plus de 164 kg.
D'après les modélisations et simulations pharmacocinétiques, la dose recommandée chez les adolescents âgés de 12 ans ou plus et pesant ≥ 30 et < 40 kg correspond à la moitié de la dose recommandée pour les adultes et les adolescents âgés de 12 ans ou plus et pesant au moins 40 kg (voir rubrique Posologie et mode d'administration).
Chez les patients pesant ≥ 30 et < 40 kg et recevant la posologie réduite, l'exposition devrait être comparable à celle observée lors des études menées dans l'indication de PPG.
Sujets âgés/sexe/origine ethnique
D'après les analyses pharmacocinétiques de population, l'âge, le sexe et l'origine ethnique n'ont aucun effet cliniquement significatif sur la pharmacocinétique du spésolimab.
Insuffisance hépatique et insuffisance rénale
Le spésolimab étant un anticorps monoclonal, il n'est pas attendu qu'il soit éliminé par voie hépatique ou rénale. Aucun essai formel n'a évalué l'effet d'une insuffisance hépatique ou rénale sur la pharmacocinétique du spésolimab.
L'analyse pharmacocinétique de population n'a pas identifié que l'exposition systémique au spésolimab était influencée par une insuffisance hépatique légère ou par une insuffisance rénale légère ou modérée.
Population pédiatrique
La pharmacocinétique du spésolimab n'a pas été étudiée chez les patients pédiatriques âgés de moins de 14 ans.
La pharmacocinétique plasmatique du spésolimab observée chez les adolescents était cohérente avec celle observée chez les adultes.
Spevigo n'a aucun effet ou un effet négligeable sur l'aptitude à conduire des véhicules et à utiliser des machines.
Les données non cliniques issues des études de toxicologie en administration répétée n'ont pas révélé de risque particulier pour l'homme.
Toxicité sur le développement et les fonctions de reproduction
Les études non cliniques menées chez la souris avec un substitut d'anticorps monoclonal anti‑IL36R murin n'ont pas mis en évidence d'effets délétères directs ou indirects sur la gestation, le développement embryofœtal ou la fertilité.
Génotoxicité
Aucune étude de génotoxicité n'a été réalisée avec le spésolimab.
Cancérogénèse
Aucune étude de cancérogenèse ou de mutagenèse n'a été réalisée avec le spésolimab.
Les seringues préremplies doivent être sorties du réfrigérateur et de leur boîte 15 à 30 minutes avant l'injection afin qu'elles reviennent à température ambiante (à une température ne dépassant pas 25 °C). Ne pas exposer les seringues préremplies au soleil.
Précautions particulières générales
Avant utilisation, il est recommandé d'inspecter visuellement chaque seringue préremplie. La solution doit être limpide à légèrement opalescente, incolore à légèrement jaune-brun. Il est possible que la solution contienne quelques particules de produit translucides à blanches. Spevigo ne doit pas être utilisé si la solution est trouble ou a changé de couleur, ou si elle contient des particules de grande taille.
Ne pas utiliser les seringues préremplies si elles sont tombées ou semblent endommagées.
Ne pas retirer le capuchon avant le moment de l'injection.
Chaque seringue préremplie est réservée à un usage unique.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Liste I
Prescription initiale hospitalière annuelle
Prescription réservée aux spécialistes et services DERMATOLOGIE
Prescription réservée aux spécialistes et services PEDIATRIE
Solution injectable (injection)
Solution limpide à légèrement opalescente, incolore à légèrement jaune-brun.
Seringue préremplie en verre assemblée avec un système automatique de protection de l'aiguille, prolongée d'une collerette, d'un piston et d'un bouchon-piston (caoutchouc bromobutyle enduit et siliconé).
Présentation : 2 seringues préremplies.
Chaque seringue préremplie contient 150 mg de spésolimab dans 1 mL.
Le spésolimab est produit à partir de cellules ovariennes de hamster chinois par la technologie de l'ADN recombinant.
Pour la liste complète des excipients, voir rubrique Liste des excipients.
Acétate de sodium trihydraté (E262)
Acide acétique glacial (E260) (pour l'ajustement du pH)
Saccharose
Chlorhydrate d'arginine
Polysorbate 20 (E432)
Eau pour préparations injectables